카-티 라고 읽어요, 자동차(CAR)가 아닙니다.
‘키메라 항원 수용체(CAR, Chimeric Antigen Receptor)’의 줄임말 입니다.
최신 글로벌에서 각광을 받고 있는 제3세대 항암을 위한 면역세포치료제 입니다
* CAR : 인공적으로 합성한 《종양인지 부위》와 《신호전달 부위》가 접합된 세포의 수용체입니다. 백혈구를 채혈하여 인공적으로 수용체를 만들고, 백만대군을 환자의 몸에 파병하는 치료 방법이다. 3세대 항암요법이다
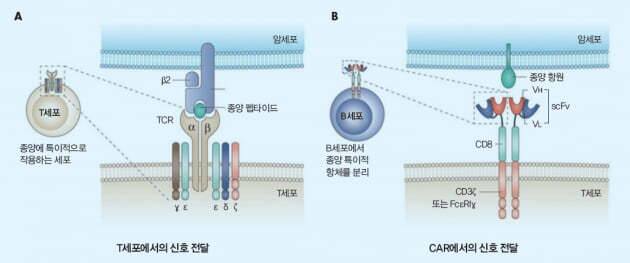
원래 정상적으로는 암세포가 있으면, 우리 몸의 면역세포들이 공격을 해서 암을 제거해야되는데 이상하게 죽이질 못하는 것이죠. 연구자들은 암이 면역을 피하는 방법이 있을 거라는 생각을 하게 됩니다.
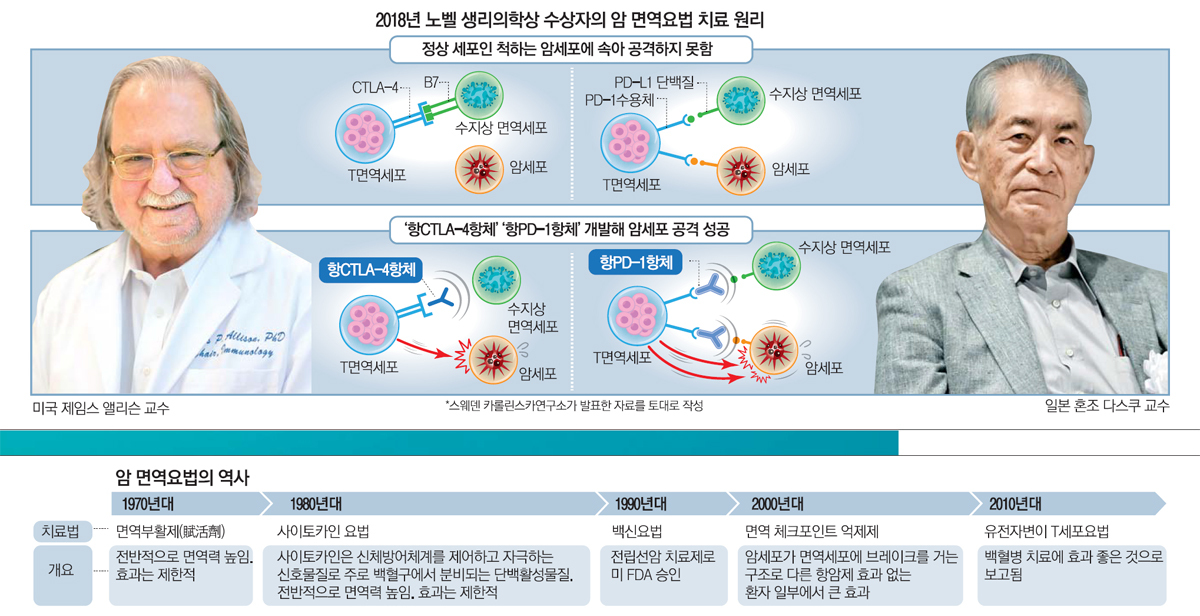
미국 MD 앤더슨 암센터의 제임스 앨리슨 교수와 일본 교토대 의과대학 혼조 다스쿠 명예교수는 이 비밀을 파헤쳤습니다.
면역 세포가 암을 죽이는 것을 방해하는 단백질이 있다는 사실을 밝혀낸 것이죠.
제임스 앨리슨 교수는 CTLA-4 단백질을 발견했고, 혼조 다스쿠 교수는 PD-1단백질을 발견했습니다.
가장 중요한 면역관문 단백질 중 하나인 Cytotoxic T Lymphocyte Antigen-4 (CTLA-4)는 T 세포의 표면에 발현되며 항원표지세포의 B7과 결합하여 T세포의 활성화 신호를 차단할 수 있고, 음성신호전달을 매개할 수 있다

이게 왜 중요하냐. 단백질의 이름은 중요치 않습니다. 이 단백질이 우리 몸의 면역세포가 제대로 암을 죽이지 못하게 방해를 한다면, 이 단백질의 활동을 막으면 암을 죽일 수 있으니까요.
- 면역세포가 암을 죽이려한다 -> 이상한 단백질이 방해한다 -> 그 단백질의 방해를 없앤다 -> 면역세포가 암을 죽인다.
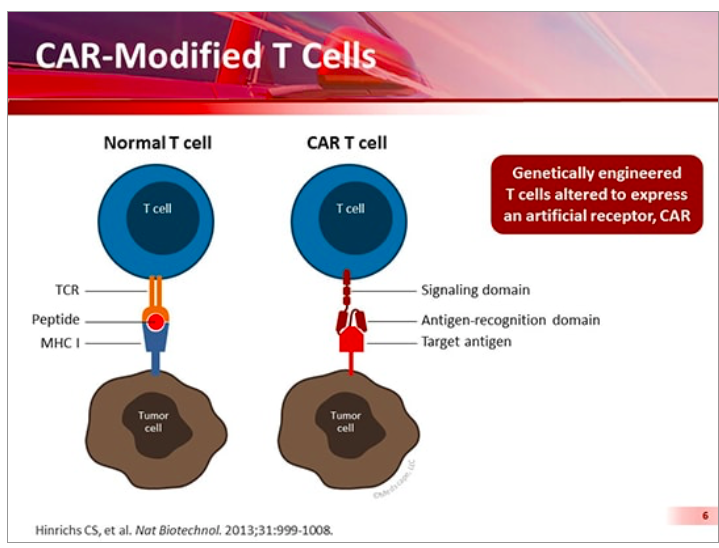
ㅇ ‘키메라 항원 수용체 T세포(CAR-T, Chimeric Antigen Receptor T cell)’의 줄임말 입니다.
ㅇ 공격수 면역세포 자체를 강하게 만드는 첨단치료법입니다.
- 암 환자의 피나 암 조직에서 T세포를 걸러낸 다음에,
체외 실험실에서 특정 암세포의 항원에 강하게 반응하도록 그 유전형질을 바꾸어 줍니다
이렇게 만든 T세포를 환자의 암조직에 넣으면 강력한 암세포 공격을 하게 됩니다.
- 아직 혈액암 같은 일부 암에서만 효과를 냅니다.
- 강력해진 T세포가 과다 면역반응을 일으킬 위험도 있다는 점은 넘어야 할 한계로 지적되고 있습니다.
ㅇ 극복해야할 기술적 한계가 있지만 잠재력이 크기 때문에 최근 글로벌 제약사들이 카티세포치료 연구에 속속 진출하고 있습니다
CAR-T 세포 면역요법 소개
CAR-T세포 면역요법은 인체의 자가면역체계를 이용해 종양세포를 공격하는 새로운 항암요법이다.
2017년 연말에 FDA가 CD19를 표적으로 하는 두 종류의 CAR-T 요법
1) Novartis사의 Kymriah(킴리아주). (★ 킴리아주는 세계 최초의 면역세포 치료제임)
2) Kite/Gilead사의 Yescarta(예스카타) 출시를 승인한 데 이어
※CD19 : Cluster of Differentiation 19의 약자입니다. (B림프구의 분화클러스터(세포표면항원무리))
2020년 7월에 CD19를 표적으로 하는 CAR-T 요법인
3) Kite/Gilead사의Tecartus(테카르투스)도 승인을 받아 출시됐다.
최근(2021년 2월 5일)에 또다시 좋은 소식이 우리에게 전해졌다.
마찬가지로 CD19를 표적으로 하는 네 번째 종류 CAR-T 치료법으로, 재발성이나 난치성의 미만성거대B세포림프종(DLBCL) 치료에 사용되는 것으로서,
4) Bristol-Myers Squibb(BMS) 산하의 Juno Therapeutics사가 개발한 Breyanzi(브레얀지주)가 승인됐다고 FDA가 발표했다.
현재 CAR-T세포 면역요법은
- 주로 선별된 환자의 T세포에 대한 유전자 변형과 개조를 통해 그 표면에 암의 특이성 키메라 항원 수용체(chimeric antigen receptor, CAR)를 발현케 하기 위하여
- 체외 증식 배양 후 다시 환자 체내에 수송하여 암 치료 목적에 달성한다(그림 1).
CAR-T 치료의 부작용
이와 같은 치료법은 항원항체 고특이성과 고친화성의 장점 및 T세포의 파괴작용을 결합하였으며 암세포를 표적으로 파괴할 수 있다. 허나, 이와 동시에 일부 요소도 CAR-T요법의 가일층 발전을 저해하고 있으며 이는 사이토카인 방출 증후군(Cytokine release syndrome,CRS)과 신경독성 등을 포함한 CAR-T요법의 흔한 부작용이다. 그중에서 CRS는 치명적일 수 있는 급성 전신성 염증반응이며 활성화된 면역세포가 염증 촉진성 사이토카인을를 다량 분비해 발생하므로 CAR-T 요법의 유효성을 가늠하는 일종 발현으로 볼 수 있다.
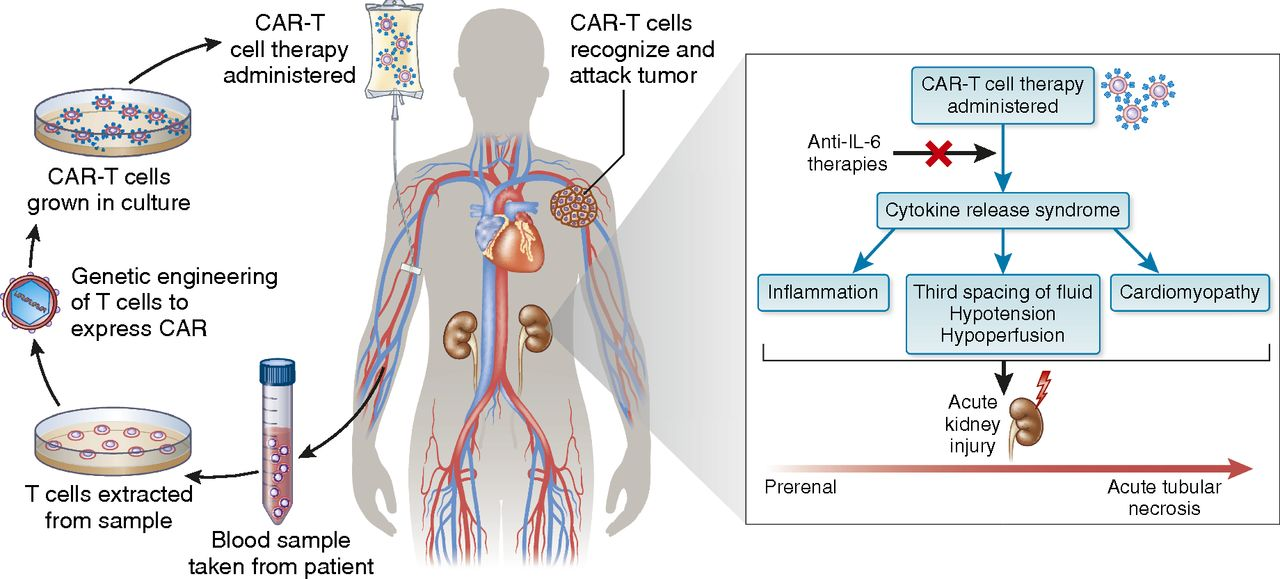
그림1. CAR-T 세포 면역요법 Flow Diagram[2]
출처:https://korea.cyagen.com/community/technical-bulletin/cart-cell-immunotherapy-brgsf-mice.html
| 식품의약품안전처노바티스의 CAR-T 치료제 ‘킴리아주(Kymriah)’의 품목허가를 승인 |
| 특히 지난 2021년 3월 5일 식품의약품안전처가 노바티스의 CAR-T 치료제 ‘킴리아주(Kymriah)’의 품목허가를 승인하면서 국내에서도 CAR-T 치료제 시장이 본격적으로 열릴 것이라는 기대감이 증폭되고 있다. 킴리아주는 2017년 미국 식품의약국(FDA)로부터 승인받은 세계 최초의 CAR-T 치료제다. 환자 본인의 면역세포를 이용한 항암면역세포 치료제인 CAR-T는 기존 항암제로 더 이상 치료가 되지 않는 백혈병, 림프종, 다발성골수종 환자에게 완치 수준의 치료효과를 나타낸다. 현재 글로벌 제약사의 CAR-T 치료제 개발 경쟁은 치열하다. 길리어드가 2017년 10월 미만성 거대 B세포 림프종(DLBCL)을 적응증으로 한 ‘예스카타(Yescarta)’를 허가받은 데 이어 지난해 2020년 7월 외투세포림프종를 적응증으로 한 ‘테카르투스(Tecartus)’를 허가받았다. 지난 2020년 2월에는 BMS(Bristol-Myers Squibb)가 재발성 또는 불응성 거대 B세포 림프종을 적응증으로 한 ‘브레얀지주(Breyanzi)’의 허가를 받았다. 국내 기업들도 앞 다퉈 CAR-T 치료제 개발에 뛰어들었으며 최근 그 성과가 나타나고 있다. 큐로셀의 CAR-T 치료제 ‘CRC01’가 국내 기업이 개발한 CAR-T 치료제 중 최초로 국내 임상에 돌입한 것이다. 큐로셀은 지난 2월 18일 식품의약품안전처로부터 재발성 또는 불응성 거대 B세포 림프종 성인 환자를 대상으로 진행하는 CD19 CAR-T세포치료제 ‘CRC01’의 임상시험을 허가받았다. 큐로셀은 2017년 설립된 CAR-T 치료제 전문기업으로, 삼성서울병원과 협력해 병원 내 CAR-T 치료제 생산용 GMP 시설을 구축한 바 있다. 이번에 허가된 임상시험은 큐로셀의 CD19 CAR-T 치료제의 안전성과 유효성을 확인하는 시험으로, 큐로셀은 최대 100명의 환자를 대상으로 임상을 진행한 후 국내 판매를 위한 조건부 허가를 신청할 계획이다. 앱클론은 올 상반기 내 식약처에 CD19 CAR-T 치료제 ‘A101’ 1상 임상시험계획(IND)을 신청할 계획이다. 이르면 5월경 신청이 가능할 것이라는 입장이다. 앱클론은 기존의 CD19 CAR-T 세포치료제가 마우스 유래 항체인 FMC63을 사용하는 반면, AT101은 작용부위가 다른 인간화 항체로 개발해 면역원성을 최소화했다고 설명했다. 아울러 앱클론은 오는 4월 10일부터 15일 개최되는 미국암연구학회(AACR)에 참가해 혈액암 대상 CAR-T 치료제 ‘AT101’와 난소암 대상 CAR-T 치료제 ‘AT501’의 연구 성과를 유펜 대학 의과대와 서울의대 공동 연구그룹과 함께 발표할 예정이다. 또한, 앱클론은 지난해 4월 임상을 위한 GMP 설비를 본사에 구축했다. 고형암을 대상으로 메소텔린(MSLN) CAR-T 치료제를 개발 중인 GC녹십자셀 또한 미국 임상 진입을 준비하고 있다. 지난해 설립한 미국 현지법인 노바셀(Novacel)을 통해 미국 내 임상에 진입한다는 목표다. GC녹십자셀은 지난 2월 ‘메소텔린 특이적인 키메라 항원 수용체 및 이를 발현하는 T세포’에 대한 국내특허 등록을 완료했다. 아울러, 특허협력조약(PCT)을 통한 미국 등 해외 특허 등록을 진행할 계획이다. 메소텔린(Mesothelin)은 고형암 타깃 CAR-T분야에서 각광받는 암 항원으로 중피종 85~90%, 췌장암 80~85%, 난소암 및 폐암 60~65% 발현율을 나타내는 것으로 알려져 있다. GC녹십자셀 관계자는 “올해 말 FDA에 임상시험 승인을 신청할 계획”이라고 말했다. 국내 임상 계획은 정해지지 않았다. 헬릭스미스는 지난해 CAR-T치료제 개발 자회사 ‘카텍셀(Cartexell)’를 설립했다. 고형암 대상 CAR-T 치료제를 개발할 계획이다. 카텍셀은 신경세포종, 난소암 등을 대상으로 ‘CX804’를 개발하고 있다. 현재는 비임상이 진행 중이다. 헬릭스미스 관계자는 “2022년 상반기 CX804 임상에 진입할 계획”이라고 말했다. 출처 : 청년의사(http://www.docdocdoc.co.kr) |
| https://premier-research.com/car-t-세포-치료-간략-소개/ 지난 해 tisagenlecleucel (KYMRIAH™)와 axicabtagene ciloleucel (YESCARTA™) 의 승인을 받아, 키메라 항원 수용체 (CAR) T세포 치료는 특정 혈액암 환자 치료의 패러다임을 바꿔놓았다. CAR T 세포 치료란? CAR T-세포 치료는 환자 자신의 T 세포가 암을 인식하고 근절할 수 있도록 하는 재설계를 포함한다. 이 T세포는 유전적으로 변형되어 인공 수용체를 표현하고 특정 항원과 결합하여 환자의 종양 세포를 죽일 수 있게 된다. T 세포 수용체 매개 면역 반응과 달리, CAR T 세포 매개 면역 반응은 세포 밖 종양 관련 항원의 직접적인 인지로 이어진다. 하지만, 면역성은 어려워질 수 있다. 그림1. 정상 vs. CAR T-세포[1] 이미지출처: Locke, F. L., MD, Gardner, R., MD, & Neelapu, S. S., MD. (2017, December 20). Test Driving CARs: Optimizing Outcomes. Retrieved from https://www.medscape.org/viewarticle/890215_transcript  CAR T 세포 치료 개발 지금까지, 두 가지의 CAR T 세포 치료가 FDA에 의해 승인 되었다.
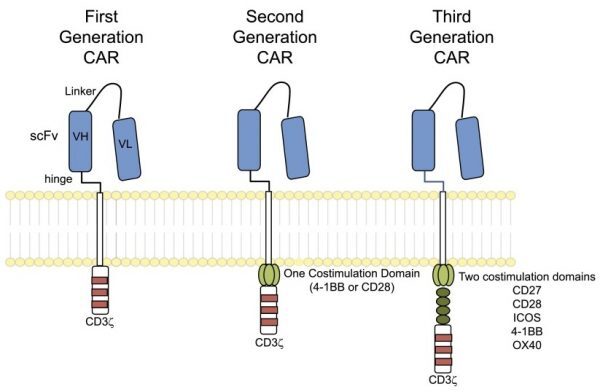
그림 2. 미국과중국의 CAR T 세포임상실험2  최근 몇 년 간, 연구원들은 치료법을 보다 안전하게 만들기 위해 CAR T세포 구조 개선 (그림 3 참조) 혹은 (suicide switch와 같은) 매커니즘 개발 등CAR T 세포 치료의 효능 강화를 위한 노력을 기했다. 그림3. CAR T 세포설계의진화[3]  CAR T 세포 치료의 이점 및 약점 [4],[5],[6] CAR T 세포 치료에는 다른 면역항암제 치료와 비교했을 때 여러 이점이 존재한다.
최근 임상 실험에서 보고된 CRS 발생률은 50~93%이며[7], 증상은 독감처럼 미미하거나 목숨을 위협할 정도의 전신성 염증반응 증후군을 수반한다. 현재 경쟁적으로 인터류킨 6 (IL-6)의 수용체와의 결합을 억제하고 IL-6가 염증 전 효과[8]를 가하는 것을 방해하는 단일 클론 항체 tocilizumab는 경감하는 경미하거나 심한 CRS를 관리하는 일선 치료법으로 간주된다. Tocilzumab이 효과를 보지 못하는 경우에는 스테로이드를 사용했다. 인간화된 면역 글로불린 항체 (IG) 항인간 면역 글로불린 항체 (anti-hIL)-6R또한 2017년 8월 미국 FDA로부터 CRS 치료 승인을 받았다. 지금까지 tocilizumab 을 이용한 예방은 CRS의 발생을 감소시키지 못했다. 견고한 종양 징후로의 성공적인 확장에 있어 향후 CAR T 세포 치료 다음 핵심 임상 질문에 답하고자 하는 연구원들의 노력과 함께 향후에도 CAR T 세포 치료에 지속되는 투자를 예상한다.
|
Introduction to CAR T-Cell Therapy Part 2: Additional Considerations & Future Opportunities |
| https://premier-research.com/blog-brief-introduction-car-t-cell-therapy-part-2/ By Ashley Herrick|July 15, 2021 |
| Beginning in 2017 with the approvals of tisagenlecleucel (Kymriah™) and axicabtagene ciloleucel (Yescarta™), chimeric antigen receptor (CAR) T-cell therapies have changed the treatment paradigm for patients with certain hematologic malignancies. Since those initial approvals, three other CAR T-cell therapies have been approved for various hematologic malignancies, but many challenges still limit the therapeutic efficacy of current CAR T-cell therapies and their use in solid tumors. In our previous post, we covered the background and current development landscape for CAR T-cell therapies. In this post, we address the advantage and challenges of this approach, strategies for managing cytokine release syndrome (CRS), and the future of CAR T-cell therapy. Advantages and challenges of CAR T-cell therapy[1],[2],[3] CAR T-cell therapy has a number of advantages over other immuno-oncology treatments, including:
The reported incidence of CRS in recent trials ranges from 50 to 93 percent,[4] with symptoms spanning the spectrum from mild flu-like symptoms to severe, life-threatening systemic inflammatory responses. Currently, tocilizumab, a monoclonal antibody that competitively inhibits the binding of interleukin-6 (IL-6) to its receptor and hinders IL-6 from exerting its pro-inflammatory effects,[5] is considered first-line treatment for mitigating moderate to severe CRS. In cases where tocilizumab is not effective, steroids have been used. Additionally, in August 2017, the FDA approved humanized immunoglobulin (IG)-1 anti-human immunoglobulin (anti-hIL)-6R for treatment of CRS. To date, prophylaxis with tocilizumab has not been shown to reduce the incidence of CRS. Future of CAR T-cell therapy: expanding into solid tumor indications In contrast to hematological malignancies, solid tumor CAR T-cell therapy is limited by the ability of the cells to traffic to and infiltrate the tumors. Solid tumors often have a physical barrier (such as the tumor stroma) that limits the penetration of the CAR T cells. In addition, the microenvironment surrounding solid tumors is often immunosuppressive. One current strategy to overcome these challenges involves direct tumor administration (rather than systemic delivery), an approach that limits the need for the CAR T cells to move to and infiltrate the tumors. Additionally, the direct administration route can help to reduce on-target, off-tumor toxicities by limiting interaction with normal tissues.[6] Other strategies being explored focus on improving CAR T-cell trafficking using receptors on CAR T cells that match tumor chemokines and engineering CAR T cells that can express heparinase, an enzyme that can degrade the physical tumor stroma barrier, thereby increasing tumor infiltration and antitumor activity.6 Looking forward, we see continued investment in CAR T-cell therapies as researchers seek to answer key clinical questions such as:
|
'97_줄기세포치료 및 면역 치료' 카테고리의 다른 글
| 새로운 의료서비스 시장 (0) | 2021.08.11 |
|---|---|
| ★ 메디포스트 '카티스템' - 퇴행성무릎연골치료제 (0) | 2021.08.11 |
| 줄기세포치료제 판매승인 현황 (0) | 2021.08.11 |
| 《첨생법》첨단재생의료‧바이오법, 향후 그려나갈 미래는? (0) | 2021.08.11 |
| 《첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률》, 첨생법에 대해서 알아보자 (1편 재생의료 파트) (0) | 2021.08.10 |




